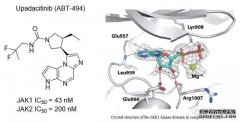
艾伯维(AbbVie)公司宣布其3期临床试验结果显示,JAK1抑制剂Upadacitinib 在类风湿关节炎给药12 周后,与adalimumab (修美乐,Humira)或安慰剂相比,达到所有次要终点。这也预示Upadacitinib(图1左)如若上市,将会成为一个超级重磅炸弹式药物。

图1 JAK1抑制剂Upadacitinib结构式及机理
修美乐(阿达木单抗注射液)是全球首个获批上市的全人源抗肿瘤坏死因子单克隆抗体,2002年在美国获批上市,目前修美乐在全球获批的适应症多达14个,在超过96个国家或地区销售。2017年的全球销售额已达184.27亿美元,累计创造了近1000亿美元的销售额(图2),成为“药王”。

图2 “药王”adalimumab近12年的销售额
JAK抑制剂除了在类风湿关节炎的突出疗效,它还应用于诸多适用症上,例如银屑病和银屑病关节炎。
目前,一项JAK1抑制剂Upadacitinib针对银屑病关节炎的临床药物试验正在中国开展,对照组为修美乐(阿达木单抗)或安慰剂。
符合条件的患友可以向我报名。需发来姓名、年龄、电话,并备注常住地址。报名后2天内会有电话接入进行具体沟通。
强调一下,试验药物可能改善皮肤症状,但是入选必须为患有银屑病关节炎。如果不符合关节炎标准,请不要报名。
Upadacitinib临床试验三期招募主要入选要求:
1、成年男性或女性,筛选时年龄≥ 18岁。
2、临床诊断为银屑病关节炎(PsA),在筛选访视前至少6个月内出现症状,并且符合银屑病关节炎分类(CASPAR)标准。
3、受试者在基线时患有活动性疾病,定义为在筛选和基线访视时≥ 3个压痛关节(基于68个关节计数)和≥ 3个肿胀关节(基于66个关节计数)。
4、受试者在筛选时至少符合以下标准之一:中心影像学检查确认X射线透视照片上显示≥ 1个骨侵蚀病灶或;hs-CRP > 实验室定义的正常值上限(ULN)。
5、诊断为活动性斑块型银屑病或有记录的斑块型银屑病病史。
6、受试者既往或当前使用至少1种非生物DMARD治疗(按最大耐受剂量)后疗效不佳(持续治疗至少12周后缺乏疗效)[(MTX、SSZ、LEF、阿普斯特、布西拉明或艾拉莫德)],或受试者无法耐受或禁忌使用DMARDs(由研究者确定)。
主要排除标准:
1、既往有任何生物免疫调节剂类药物暴露。
2、既往有Janus激酶(JAK)抑制剂类药物暴露(包括但不仅限于鲁索替尼、托法替尼、巴瑞替尼和菲格替尼)。
3、在研究药物首次给药前30天或药物的5个半衰期内(以较长者为准)接受过任何研究用药物治疗,或目前已入组另一项临床研究。
4、当前使用的非生物DMARDs多于2种或使用除MTX、SSZ、LEF、阿普斯特、HCQ、布拉西明或艾拉莫德以外的DMARDs,或基线时联用MTX与LEF。
5、当前或既往感染病史。
可选医院和所在城市:
1、四川大学华西医院 成都
2、株洲市中心医院 株洲
3、内蒙古科技大学包头医学院第一附属医院 包头
4、山西医科大学第二医院 太原
5、上海长海医院 上海
6、济宁市第一人民医院 济宁
7、蚌埠医学院附属第一医院 蚌埠
8、苏州大学第一附属医院 苏州
9、复旦大学附属华山医院 上海
10、昆明医科大学第一附属医院 昆明
11、新疆维吾尔自治区人民医院 乌鲁木齐
12、 宁波市第一医院 宁波
13、 北京大学第三医院 北京
14、 厦门大学附属第一医院 厦门
15、汕头大学医学院第一附属医院 汕头
符合条件的患友可以向我报名。需发来姓名、年龄、电话,并备注常住地址。报名后2天内会有电话接入进行具体沟通。
进入国家药物临床试验登记与信息公示平台,搜索编号CTR20180507,可了解详尽情况。


 生物制剂沦为对照组,新
生物制剂沦为对照组,新 因隐瞒激素成分,银屑病
因隐瞒激素成分,银屑病 中国银屑病疾病负担和患
中国银屑病疾病负担和患 关于网络信息,对银屑病
关于网络信息,对银屑病